Présentation du projet de Recherche
Connue depuis 2000 ans dans ses manifestations cliniques, l’inflammation ou réaction inflammatoire est un mode de réponse des tissus vivants vascularisés face à une agression. Elle peut relever de différentes causes, infectieuses (bactérienne, virale, parasitaire), immunologiques, tumorales, ou traumatismes (intervention chirurgicale, brûlure…). Elle peut également être la conséquence d’une nécrose tissulaire, elle-même secondaire à de nombreuses causes, par exemple une occlusion artérielle.
Grâce à vous, la Fondation Arthritis finance ce laboratoire depuis 2 ans !
L’inflammation
L’inflammation est un processus habituellement bénéfique : son but est d’éliminer l’agent pathogène et de réparer les lésions tissulaires. Parfois l’inflammation peut être néfaste du fait de l’agressivité de l’agent pathogène, de sa persistance, du siège de l’inflammation, par anomalies des régulations du processus inflammatoire, ou par anomalie quantitative ou qualitative des cellules intervenant dans l’inflammation. Les cellules qui interviennent dans les mécanismes de l’inflammation sont à la fois des cellules circulantes (polynucléaires neutrophiles, monocytes, polynucléaires éosinophiles, polynucléaires basophiles, plaquettes, lymphocytes, plasmocytes) qui migrent vers le tissu interstitiel et des cellules résidentes des tissus interstitiels (macrophages, histiocytes, mastocytes, fibroblastes). Ces cellules libèrent de nombreux médiateurs cellulaires pro-inflammatoires, tels que histamine, sérotonine, prostaglandines, cytokines (IL1, IL6, TNF-a) et radicaux libres oxygénés.
Le traitement des maladies inflammatoires est généralement basé sur l’inhibition de ces médiateurs pro-inflammatoires. Les progrès effectués dans la compréhension des mécanismes de la résolution de l’inflammation, ont permis l’émergence de pistes thérapeutiques prometteuses qui aurait pour but de stimuler ces anti-inflammatoires endogènes mis en échec au cours de l’inflammation chronique non résolue. L’équipe co-dirigée par Véronique Witko-Sarsat et Luc Mouthon s’intéresse aux mécanismes de l’inflammation et au remodelage au cours de maladies vasculaires. Nous avons rencontré Véronique Witko-Sarsat qui nous a parlé avec enthousiasme de leur projet de recherche soutenu financièrement par la Fondation Arthritis qui vise à étudier les mécanismes moléculaires impliqués dans l’apoptose du neutrophile.
Le neutrophile dans l’inflammation
Les neutrophiles sont des cellules de l’immunité innée indispensable à la défense contre les pathogènes. Lors de la phase aiguë des maladies inflammatoires, ils sont rapidement recrutés au site de la lésion ou de l’infection pour détruire les pathogènes.
L’apoptose du neutrophile, qui suit son activation, permet d’éviter sa nécrose, au cours de laquelle les neutrophiles détruisent les tissus et amplifient l’inflammation. Les neutrophiles apoptotiques sont ensuite phagocytés par les macrophages induisant une réaction anti-inflammatoire. Ainsi, l’apoptose des neutrophiles est une étape essentielle de la résolution de l’inflammation, et peut être considérée comme une cible pertinente pour combattre l’inflammation dans les nombreuses pathologies impliquant les neutrophiles. De plus, il a été montré que dans certaines pathologies infectieuses (méningite, mucoviscidose), un traitement anti-inflammatoire combiné aux antibiotiques favorisait la résolution de l’inflammation. Cependant, aucun traitement ciblant spécifiquement les neutrophiles n’est actuellement disponible.
Un nouveau rôle pour PCNA
Le neutrophile est une cellule en fin de différenciation, dépourvu de capacité proliférative. Sa durée de vie courte (quelques heures dans la circulation) peut être allongée au site l’inflammatoire selon des mécanismes très mal connus.
Il a été montré que des protéines régulatrices du cycle cellulaire contrôlaient la survie du neutrophile. De façon tout à fait surprenante, l’équipe de Véronique Witko-Sarsat a découvert que la protéine PCNA (proliferating cell nuclear antigen), facteur nucléaire indispensable à la réplication de l’ADN dans les cellules prolifératives a une localisation exclusivement cytoplasmique dans le neutrophile, et régule sa survie grâce à son rôle anti-apoptotique (J Exp Med, 2010).
PCNA n’a pas d’activité enzymatique et est considéré comme une protéine « assembleuse » (ou protéine plateforme) bien décrite dans le noyau des cellules proliférantes. Ainsi, un peptide compétiteur provenant de p21/waf1 (partenaire de PCNA) déclenche l’apoptose du neutrophile, montrant que la modulation de la plateforme de PCNA cytoplasmique dans le neutrophile peut potentiellement moduler la réponse inflammatoire. Comme nous l’indique Véronique Witko-Sarsat, « cette découverte est à l’origine de 2 dépôts de brevet Européen par Inserm Transfert ! ».
Les objectifs du projet dirigé par Véronique Witko-Sarsat sont :
1. d’étudier les mécanismes moléculaires contrôlant la balance survie/apoptose dans le neutrophile et
2. d’élucider les mécanismes régulant la « plateforme protéique » PCNA dans le cytosoplasme des neutrophiles, cible potentielle pour un traitement inflammatoire ciblé.
Ainsi, dans le neutrophile, PCNA a un rôle essentiel dans la survie du neutrophile et bloque son apoptose. Cette nouvelle voie de survie dans les neutrophiles ouvre des perspectives intéressantes pour potentialiser la résolution de l’inflammation et donc des opportunités dans la conception de nouvelles molécules anti-inflammatoires : Favoriser l’apoptose du neutrophile en ciblant PCNA pourrait dès lors constituer une nouvelle piste thérapeutique anti-inflammatoire prometteuse.
 Schéma du nouveau rôle de PCNA dans le neutrophile.
Schéma du nouveau rôle de PCNA dans le neutrophile.
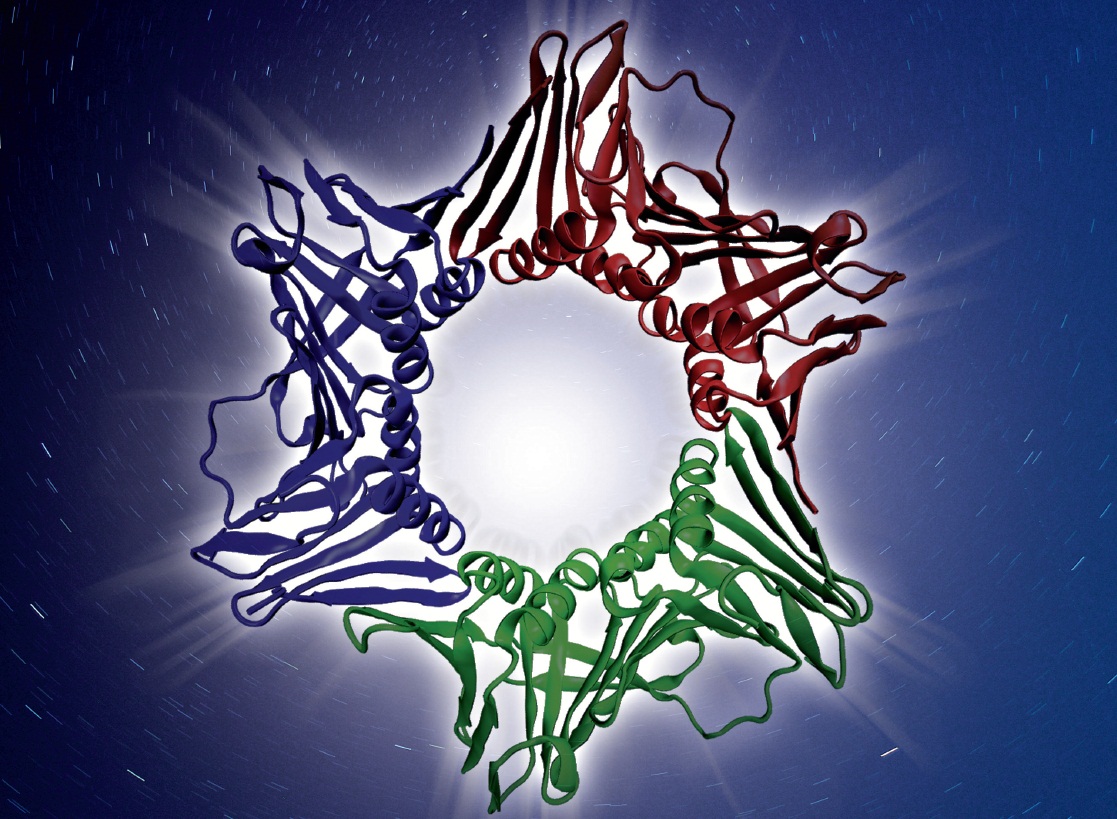
PCNA est une protéine trimérique abondante dans le noyau des cellules proliférante. Dans le neutrophile mature, qui est une cellule qui ne prolifère pas, PCNA est uniquement cytoplasmique comme le montre la photo de neutrophile dont les noyaux caractéristiques polylobés apparaissent en bleu et PCNA, marqué avec un anticorps fluorescent apparaît en rouge. Lorsque le neutrophile survit (panel A), PCNA cytoplasmique s’associe avec des protéases impliquées dans l’apoptose, (procaspases) et bloque leur activation. Lorsque le neutrophile reçoit des signaux de mort, de façon physiologique ou en présence d’un peptide provenant de la proteine P21/waf1 (panel B) qui se lie spécifiquement à PCNA (peptide en jaune sur la modélisation tridimensionnelle de PCNA), PCNA est dégradé et le neutrophile entre en apoptose. Ce schéma montre que la survie du neutrophile est sous la dépendance de PCNA, protéine dont on ne connaissait jusqu’alors que ses activités nucléaires.
L’équipe
Unité : INSERM U1016/CNRS UMR 8104/Université Paris Descartes UMR-S1016
Lieu : Institut Cochin, Département Immunologie et Hématologie, Hôpital Cochin, Paris
Composition de l’équipe : Equipe « Neutrophile et vascularites », co-dirigée par Véronique Witko-Sarsat et Luc Mouthon
2 chercheurs statutaires, 3 techniciens, 2 chercheurs post-doctorants et 4 doctorants.
Thématique : Mécanismes de l’inflammation et du remodelage au cours de maladies vasculaires, en particuliers les vascularites autoimmunes.
Références
1. Witko-Sarsat V, Mocek J, Bouayad D, Tamassia, N., Ribeil, J. A., Candalh, C., Davezac, N., Reuter, N., Mouthon, L., Hermine, O., Pederzoli-Ribeil, M., Cassatella, M. A.. Proliferating cell nuclear antigen acts as a cytoplasmic platform controlling human neutrophil survival. J Exp Med. 2010; 207:2631-2645.
2. Witko-Sarsat V, Pederzoli-Ribeil M, Hirsh E, Sozzani S, Cassatella M. Regulating neutrophil apoptosis: new players enter the game. Trends Immunol. 2011; in press.